



近日,上海光源科学中心研究员诸颖、胡钧、王丽华和上海交通大学教授樊春海院士的联合团队发展了一种X射线遗传编码探针,成功在同步辐射X射线显微镜上实现了对细胞内特定蛋白质的内源标记和原位纳米分辨成像。该研究成果近日以Genetically encoded X-ray cellular imaging for nanoscale protein localization为题发表于《国家科学评论》上(National Science Review,2020,DOI: 10.1093/nsr/nwaa055)。
从第一台光学显微镜到荧光显微镜再到最新的超分辨荧光显微镜,显微成像技术的发展始终伴随着生物学研究的发展。与可见光相比,X射线的波长很短,因此,基于同步辐射的X射线显微镜具有内禀的高分辨和强穿透能力,可以对完整细胞进行纳米分辨成像。然而,由于缺乏高特异性生物探针,现有的X射线显微成像多依赖于外源探针,步骤较多且容易带来误差。因此,寻找“X射线显微镜的GFP”成为一个迫切需求(GFP即绿色荧光蛋白,是由钱永健等人发展的荧光成像遗传编码探针)。
研究者将经过基因改造的过氧化物酶(APEX2)用作X射线遗传编码探针。在哺乳动物细胞中,带有APEX2标签的特定蛋白质表达后,APEX2可以原位催化DAB单体形成X射线显微镜下可见的聚合物,从而实现成像。使用新探针APEX2,研究者能够以25-30 nm的超高空间分辨率观察到细胞内多种蛋白质分子和亚细胞结构,其成像能力优于EGFP标记的荧光共聚焦显微镜,二者的半峰全宽(FWHM)分别约为20-30 nm和超过200 nm。X射线标签具有优越的光稳定性,可以长时间观察细胞内和细胞间发生的分子事件。而利用X射线的高能量分辨性质,还可以实现对细胞内多种蛋白质的同时观测。该研究建立了一个高通用性的同步辐射细胞显微成像平台。
该工作前后历时7年,得益于上海光源科学中心对同步辐射前沿应用in-house研究的长期支持,同时也得到了加拿大光源和韩国浦项光源等多个同步辐射软X射线谱学显微线站的帮助。相关工作得到国家重点研发计划、中国科学院重大科技基础设施开放研究项目、国家自然科学基金委、卢嘉锡国际团队项目和中科院青年创新促进会的支持。
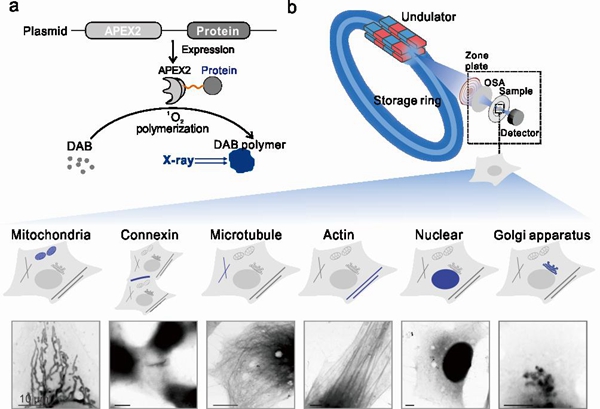
X射线成像遗传编码探针对细胞内特定蛋白质的内源标记和原位纳米分辨成像