2月16日,国家蛋白质科学研究(上海)设施支持清华大学/西湖大学用户柴继杰教授团队与其合作单位南京农业大学王源超教授团队发现了一种植物新型免疫激活机制,揭示了植物多聚半乳糖醛酸酶抑制蛋白(Polygalacturonase-inhibiting protein, PGIP)特异性识别病原菌果胶多聚半乳糖醛酸水解酶(Polygalacturonase, PG)并劫持其酶活性来触发植物先天免疫的独特分子机制,对认识植物免疫系统、合理利用和精准改造PGIP提高作物抗性具有重要的指导意义。相关成果以“A plant mechanism of hijacking pathogen virulence factors to trigger innate immunity”为题,在Science上发表。
本研究利用中国科学院上海高等研究院国家蛋白质科学研究(上海)设施BL18U1线站,解析了聚半乳糖醛酸酶PvPGIP2N274D-FpPG和 PGLR 的晶体结构(PDBID分别为 8IKW和8IKX),并利用蛋白质设施BL19U1线站完成前期数据筛选,为该项研究成果提供了重要支持。同时,用户利用上海高研院上海光源BL02U1和BL10U2线站开展了蛋白晶体的相关衍射实验。
在植物与病原菌的长期斗争中,效应子是病原菌攻击寄主植物的武器,病原菌分泌效应子攻击植物的免疫系统导致植物感病;植物进化出精细、复杂的免疫系统,通过识别病原菌效应子激活植物抗性从而保护自身免受侵害。植物的细胞壁由高度复杂的纤维素、半纤维素、果胶聚糖结构组成,是病原菌成功入侵植物需要突破的重要防线。病原菌在侵染植物的早期分泌的效应子中包含大量的细胞壁降解酶(Cell wall degrading enzyme, CWDE),破坏植物细胞壁。
果胶多聚半乳糖醛酸水解酶(PG)是病原菌分泌的一类重要的致病效应子,具有保守的细胞壁降解酶活性,对病原菌的致病性至关重要。学界普遍认为多聚半乳糖醛酸酶抑制蛋白PGIP通过抑制PG酶活发挥抗病功能。然而,植物PGIP与病原菌PG互作激活植物免疫的分子机制一直不清楚。
该项研究首次解析了分辨率为1.93Å的PvPGIP2-FpPG复合物结构。与之前所有报道的细胞壁降解酶抑制蛋白(CWDE-inhibiting protein, CWDEIP)与CWDE的复合物结构不同,PvPGIP2并未结合在FpPG的酶活中心,表明PvPGIP2与FpPG存在独特的作用机制。PGIP-PG形成一个全新的多聚半乳糖醛酸水解酶,与PG单体具有完全不同的酶动力学活性。该研究表明植物PGIP并不直接抑制PG酶活性,而是改变底物结合方式,促进能够激活植物免疫的高聚OG产生,并减少抑制植物免疫的低聚OG产生。该研究首次揭示了植物细胞壁降解酶抑制蛋白通过调控病原菌细胞壁降解酶底物转化激活植物免疫的全新机制。在此基础上,该研究进一步对PGIP进行了工程化改造。改造后的PGIP不仅能产生更多的OG10-15,并且获得了新的识别PG的功能。
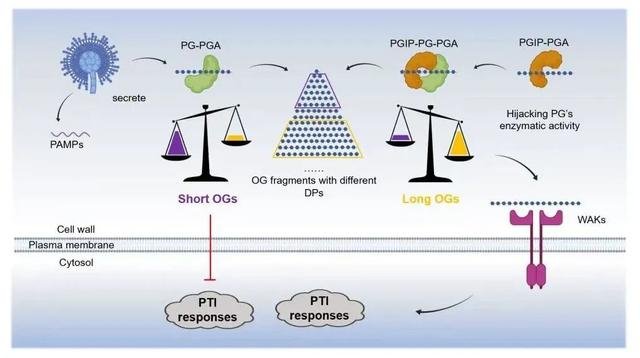
PGIP-PG介导的植物免疫响应
综上所述,该研究揭示了多聚半乳糖醛酸酶抑制蛋白PGIP和多聚半乳糖醛酸酶PG互作激活植物免疫的全新分子机制,为植物与病原物互作领域提供了全新的研究范式。对PGIP的定向编辑,提高PGIP识别PG激活植物抗性的功能,对认识植物免疫系统、合理利用和精准改造植物免疫元件提高作物抗性具有重要的指导意义。对其机制的解析对认识生物互作的本质,改造作物的持久广谱抗病性具有重要的理论和实践价值。
原文链接:https://www.science.org/doi/10.1126/science.adj9529#sec-3



 打印
打印