科技动态
2022年9月21日,国家蛋白质科学研究(上海)设施用户清华大学柴继杰教授与合作团队在《自然》杂志发表题为“Plant receptor-like protein activation by a microbial glycoside hydrolase”的论文。
该研究通过解析受体RXEG1单独(apo-RXEG1)、受体-配体识别(RXEG1-XEG1)和受体-配体-共受体复合物(RXEG1-XEG1-BAK1)等多种不同状态的结构,结合生物化学和植物细胞生物学等手段进一步阐明了其发挥功能的具体机制。
该研究阐明了细胞膜受体蛋白RXEG1识别病原菌核心致病因子XEG1激活植物免疫的作用机制,首次揭示了细胞膜受体蛋白具有激活免疫活性和直接抑制致病因子XEG1酶活的双重免疫功能,对认识、合理利用和精准改造植物免疫受体,提高作物广谱抗性具有重要的指导意义。
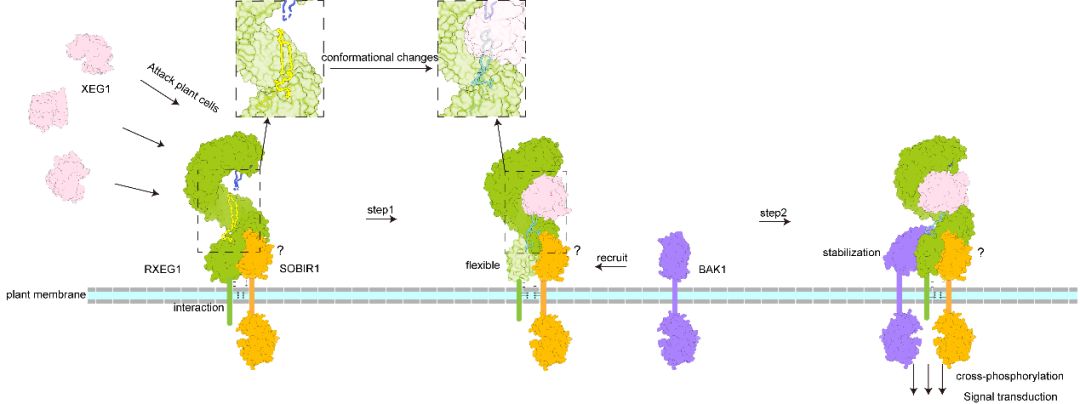
图1:RXEG1受体识别致病因子XEG1活化免疫的示意图
在与病原菌的长期斗争中,植物进化出精细、复杂的多层免疫系统保护自身免受侵害。定位于细胞膜表面的植物模式识别受体(Pattern Recognition Receptors,PRRs)作为监控病原菌侵害的“前哨”,通过识别病原菌的病原相关分子模式(Microbe- or Pathogen-Associated Molecular Patterns,MAMPs/PAMPs),激活对多种病原菌的广谱抗性 (PRR-Triggered Immunity,PTI)。PRR主要是由受体激酶(Receptor Kinases, RKs)和受体蛋白(Receptor-Like Proteins, RLPs)组成。其中重要的一类PRR胞外配体识别结构域由富含亮氨酸重复基序(LRR)构成,因此被称为LRR型PRR,其可进一步分为LRR- RKs和LRR- RLPs。尽管目前我们对受体激酶 (LRR- RKs)的配体识别及活化的分子机制有了较为深刻的理解,但是对于参与植物抗病的另一大类LRR- RLPs的配体识别及活化分子机制一直不清楚。
在最新这篇论文中,研究发现RXEG1主要通过胞外N端帽子和C端岛区结合XEG1。XEG1的结合引起了RXEG1岛区及C末端的构像发生明显变化,从而诱导共受体BAK1的结合并进一步稳定RXEG1岛区和C端4个LRR基序的构象变化。受体-配体-共受体活化复合物(RXEG1-XEG1-BAK1)结构显示XEG1并不直接参与RXEG1与共受体BAK1的互作,而是通过别构效应间接促进RXEG1与BAK1的异源二聚化。体内生化和功能分析也明确了XEG1诱导RXEG1岛区构象改变进而诱导BAK1结合形成异源二聚体来激活下游免疫信号通路的分子机制。
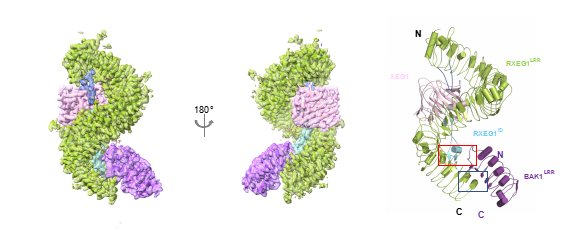
图2:RXEG1-XEG1-BAK1复合体结构
有趣的是,该研究发现受体RXEG1的两个loop区恰好结合在XEG1的酶活性位点的口袋中。王源超教授实验室先前研究已经揭示XEG1的酶活性对于病原菌的致病性是必需的。该研究通过体外酶活抑制实验及植物体内实验证明了破坏RXEG1免疫识别受体功能后,RXEG1依然能够发挥对XEG1水解酶抑制作用来抑制病原菌的侵染。这些现象表明,受体RXEG1除了激活免疫反应来抑制病原菌的侵染外,也通过抑制致病因子XEG1的糖基水解酶活性来直接发挥抗病功能。
综上所述,该研究首次揭示了植物免疫受体蛋白的配体识别及激活的分子机制,并发现了植物受体蛋白在免疫过程中的双重功能。为理解植物受体蛋白家族的功能及结构研究提供了范式。
蛋白质设施对该项工作的支持
国家蛋白质科学研究(上海)设施蛋白质晶体结构分析系统复合物晶体结构线站(BL19U1)为XEG1-RXEG1(LRR)复合体(PDB ID:7DRB )的晶体衍射数据收集提供了重要支持。
原文链接:
https://doi.org/10.1038/s41586-022-05214-x



 打印
打印